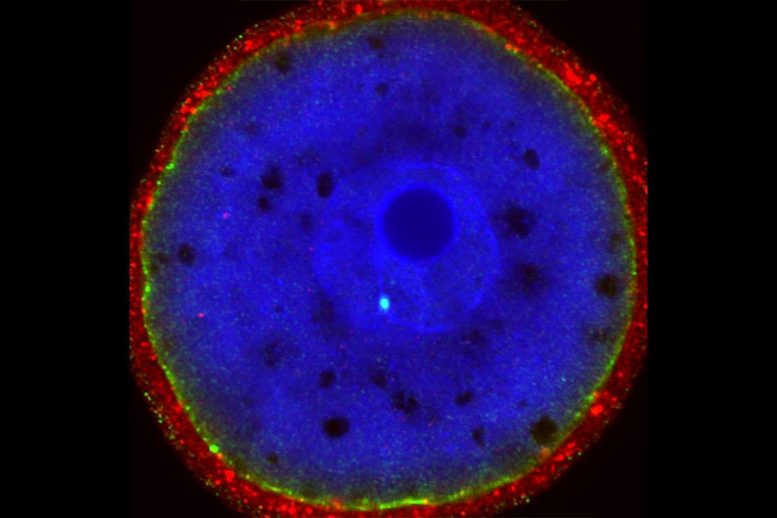
Окрашивание на RAD51 (яркая голубая точка) в оплодотворенном одноклеточном эмбрионе мыши показывает восстановление CRISPR-индуцированного разрыва ДНК. Кредит: Изображение любезно предоставлено исследователями.
Новый метод, разработанный исследователями Института Макговерна, может привести к более безопасным и эффективным генным методам лечения.
Редактирование генов, или целенаправленное изменение последовательности ДНК гена, является мощным инструментом для изучения того, как мутации вызывают болезнь, и для внесения изменений в ДНК человека в терапевтических целях. Новый метод редактирования генов, который можно использовать для обеих целей, в настоящее время разработан группой под руководством Гопинга Фэна, Джеймса У. (1963) и Патрисии Т. Пойтрас, профессора мозговых и когнитивных наук в Массачусетском технологическом институте.
«Этот технический прогресс может ускорить создание моделей болезней у животных и, что особенно важно, открывает совершенно новую методологию коррекции мутаций, вызывающих заболевание», - говорит Фен, который также является членом Института Броуда Гарварда и Массачусетского технологического института, а также заместитель директора Института исследований мозга Макговерна при Массачусетском технологическом институте. Новые результаты были опубликованы онлайн 26 мая 2021 года в журнале. Ячейка.
Генетические модели болезни
Основная цель лаборатории Фенга - точно определить, что идет не так с нарушениями развития нервной системы и психоневрологическими расстройствами, путем создания моделей на животных, несущих генные мутации, вызывающие эти расстройства у людей. Новые модели могут быть созданы путем введения в эмбрионы средств редактирования генов вместе с фрагментом ДНК, несущим желаемую мутацию.
В одном из таких методов инструмент редактирования генов CRISPR запрограммирован на разрезание целевого гена, тем самым активируя естественные механизмы ДНК, которые «восстанавливают» поврежденный ген с помощью введенной матричной ДНК. Затем сконструированные клетки используются для создания потомства, способного передавать генетические изменения следующим поколениям, создавая стабильную генетическую линию, в которой тестируются болезнь и методы лечения.
Хотя CRISPR ускорил процесс создания таких моделей заболеваний, этот процесс может занять месяцы или годы. Причины неэффективности заключаются в том, что многие обработанные клетки вообще не претерпевают желаемого изменения последовательности ДНК, и изменение происходит только на одной из двух копий гена (для большинства генов каждая клетка содержит две версии, одну от отца и одну от мама).
Стремясь повысить эффективность процесса редактирования генов, команда лаборатории Фэна первоначально выдвинула гипотезу, что добавление белка репарации ДНК под названием RAD51 к стандартной смеси инструментов редактирования генов CRISPR увеличит шансы того, что клетка (в данном случае оплодотворенная мышь) яйцо или одноклеточный эмбрион) подвергнется желаемому генетическому изменению.
В качестве тестового примера они измерили скорость, с которой они смогли вставить («нокаутировать») мутацию в ген. Чад2 что связано с аутизмом. Общая доля правильно отредактированных эмбрионов осталась неизменной, но, к их удивлению, значительно более высокий процент содержал желаемое изменение генов на обеих хромосомах. Тесты с другим геном дали такой же неожиданный результат.
«Редактирование обеих хромосом одновременно обычно очень редко», - объясняет постдок Джонатан Уайлд. «Высокая скорость редактирования, наблюдаемая с помощью RAD51, была действительно поразительной, и то, что начиналось как простая попытка сделать мутантный Чад2 мыши быстро превратились в гораздо более крупный проект, сфокусированный на RAD51 и его приложениях для редактирования генома », - говорит Уайлд, соавтор Ячейка статья с ученым-исследователем Томоми Аидой.
Молекулярный копировальный аппарат
Затем команда лаборатории Фэна приступила к изучению механизма, с помощью которого RAD51 усиливает редактирование генов. Они предположили, что RAD51 задействует процесс, называемый репарацией интергомолога (IHR), при котором разрыв ДНК на одной хромосоме восстанавливается с использованием второй копии хромосомы (от другого родителя) в качестве матрицы.
Чтобы проверить это, они вводили мышиным эмбрионам RAD51 и CRISPR, но не использовали матричную ДНК. Они запрограммировали CRISPR на разрезание только последовательности гена на одной из хромосом, а затем проверили, была ли она восстановлена, чтобы соответствовать последовательности на неразрезанной хромосоме. Для этого эксперимента им пришлось использовать мышей, у которых последовательности материнских и отцовских хромосом были разными.
Они обнаружили, что контрольные эмбрионы, которым вводили только CRISPR, редко демонстрировали восстановление IHR. Однако добавление RAD51 значительно увеличило количество эмбрионов, в которых ген, нацеленный на CRISPR, был отредактирован для соответствия неразрезанной хромосоме.
«Предыдущие исследования IHR показали, что он невероятно неэффективен в большинстве клеток», - говорит Уайлд. «Наше открытие, что это происходит гораздо легче в эмбриональных клетках и может быть усилено с помощью RAD51, предполагает, что более глубокое понимание того, что делает эмбрион способным к этому типу репарации ДНК, может помочь нам разработать более безопасные и более эффективные методы генной терапии».
Новый способ исправить мутации, вызывающие болезни
Стандартные стратегии генной терапии, которые полагаются на введение корректирующего участка ДНК, служащего шаблоном для исправления мутации, включают процесс, называемый гомологически-направленной репарацией (HDR).
«Стратегии на основе HDR по-прежнему страдают низкой эффективностью и несут риск нежелательной интеграции донорской ДНК по всему геному», - объясняет Фэн. «IHR имеет потенциал преодолеть эти проблемы, потому что он полагается на естественные клеточные пути и собственную нормальную хромосому пациента для исправления вредоносной мутации».
Команда Фэна продолжила идентифицировать дополнительные белки, связанные с репарацией ДНК, которые могут стимулировать IHR, в том числе несколько, которые не только способствуют высоким уровням IHR, но и подавляют ошибки в процессе репарации ДНК. Дополнительные эксперименты, которые позволили команде изучить геномные особенности событий ММСП, дали более глубокое понимание механизма ММСП и предложили способы использования этого метода для повышения безопасности генной терапии.
«Несмотря на то, что еще многое предстоит узнать об этом новом применении ММСП, наши результаты являются основой для нового подхода к генной терапии, который может помочь решить некоторые из больших проблем с текущими подходами», - говорит Аида.
Ссылка: «Эффективная эмбриональная гомозиготная конверсия гена посредством репарации интергомологов с усилением RAD51» Джонатан Дж. Уайлд, Томоми Аида, Рикардо С.Х. дель Росарио, Тобиас Кайзер, Пеймин Ци, Мартин Вениш, Цянге Чжан, Стивен Колвин и Гуопин Фэн, 26 мая 2021 г. , Ячейка.
DOI: 10.1016 / j.cell.2021.04.035
Это исследование было поддержано Центром исследований аутизма Хока Э. Тана и К. Лизы Янг при Массачусетском технологическом институте, Центром исследований психиатрических заболеваний Пойтраса при Массачусетском технологическом институте, грантом Центра Конте NIH / NIMH и офисом директора Национального института здравоохранения.






