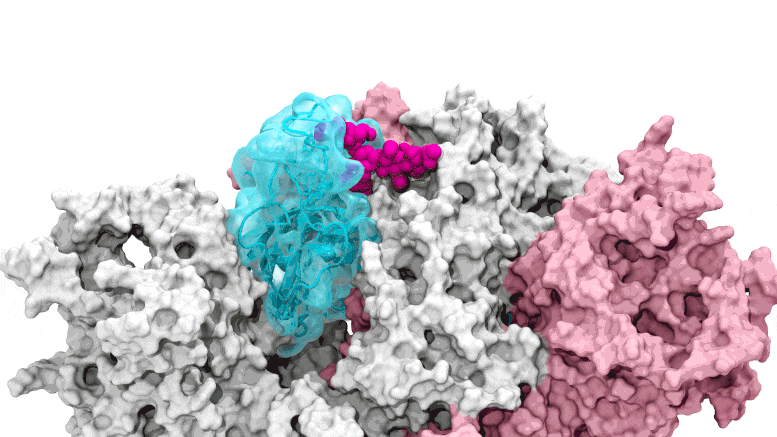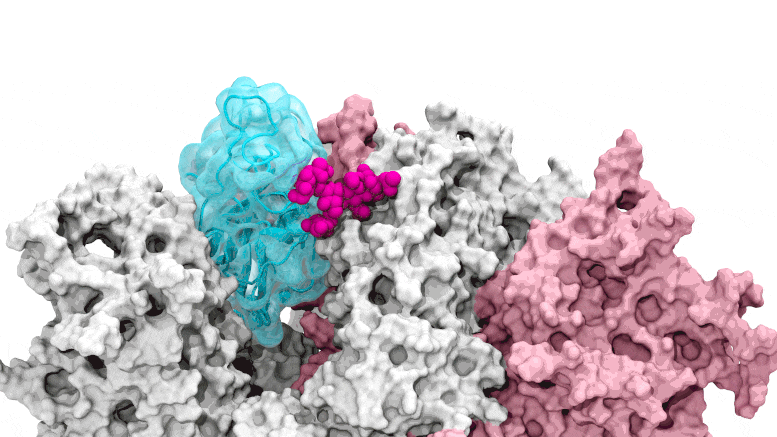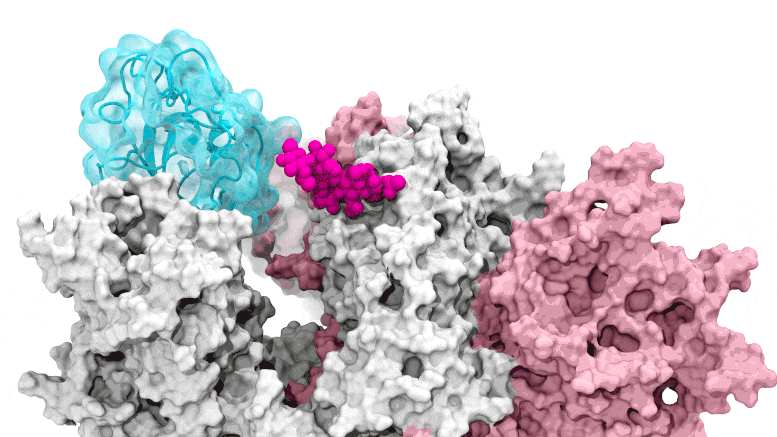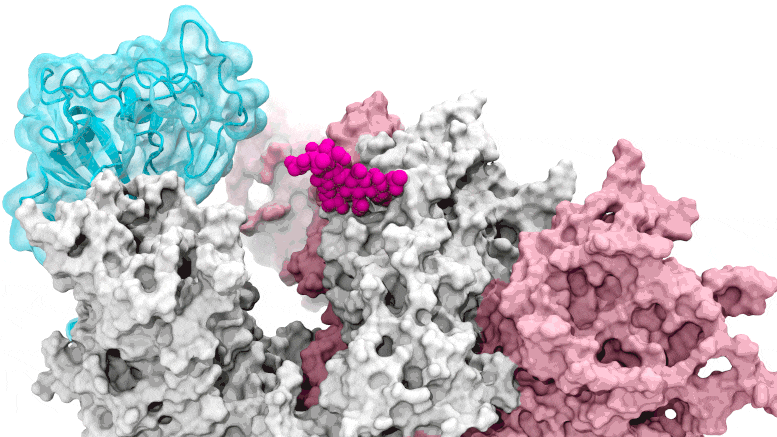
La porte des glycanes s'ouvre : les simulations basées sur le supercalcul dépeignent le glycane N343 (magenta) agissant comme un pied de biche moléculaire pour ouvrir le domaine de liaison au récepteur du pic SARS-CoV-2, ou RBD (cyan), d'un « bas » à un « haut ». " position. Crédit : Terra Sztain, Surl-Hee Ahn, Lorenzo Casalino (Amaro Lab, UC San Diego)
Les films dérivés de supercalculateurs révèlent les détails d'un enrobage de sucre trompeur sur la protéine de pointe, offrant de nouvelles possibilités pour bloquer l'entrée et l'infection des cellules.
Depuis les premiers jours de la pandémie de COVID, les scientifiques ont poursuivi de manière agressive les secrets des mécanismes qui permettent le syndrome respiratoire aigu sévère coronavirus 2 (SRAS-CoV-2) pour pénétrer dans les cellules humaines saines et les infecter.
Au début de la pandémie, Rommie Amaro, de l'Université de Californie à San Diego, une chimiste biophysique computationnelle, a aidé à développer une visualisation détaillée de la protéine de pointe du SRAS-CoV-2 qui se verrouille efficacement sur nos récepteurs cellulaires.
Maintenant, Amaro et ses collègues de recherche de l'UC San Diego, de l'Université de Pittsburgh, de l'Université du Texas à Austin, L'Université de Columbia et l'Université du Wisconsin-Milwaukee ont découvert comment les glycanes - des molécules qui constituent un résidu sucré sur les bords de la protéine de pointe - agissent comme des passerelles d'infection.
Paru le 19 août dans la revue Nature Chemistry, une étude de recherche dirigée par Amaro, co-auteur principal Lillian Chong à l'Université de Pittsburgh, premier auteur et étudiant diplômé de l'UC San Diego Terra Sztain et co-premier auteur et chercheur postdoctoral de l'UC San Diego Surl-Hee Ahn, décrit la découverte de des « portes » de glycane qui s'ouvrent pour permettre l'entrée du SRAS-CoV-2.
"Nous avons essentiellement compris comment le pic s'ouvre et infecte réellement", a déclaré Amaro, professeur de chimie et de biochimie et auteur principal de la nouvelle étude. «Nous avons débloqué un secret important du pic dans la façon dont il infecte les cellules. Sans cette porte, le virus est essentiellement rendu incapable d'infection.
Les simulations pilotées par le supercalcul dépeignent le glycane N343 (magenta) agissant comme un pied-de-biche moléculaire pour ouvrir le domaine de liaison au récepteur du pic SARS-CoV-2, ou RBD (cyan), d'une position « bas » à une position « haute ». Crédit : Terra Sztain, Surl-Hee Ahn, Lorenzo Casalino (Amaro Lab, UC San Diego)
Amaro pense que la découverte de la porte de l'équipe de recherche ouvre des voies potentielles pour de nouvelles thérapies pour contrer l'infection par le SRAS-CoV-2. Si les portes des glycanes pouvaient être pharmacologiquement verrouillées en position fermée, alors le virus est effectivement empêché de s'ouvrir à l'entrée et à l'infection.
Le revêtement de glycanes de la pointe aide à tromper le système immunitaire humain car il se présente comme rien de plus qu'un résidu sucré. Les technologies précédentes qui imaginaient ces structures décrivaient des glycanes dans des positions statiques ouvertes ou fermées, ce qui au départ n'attirait pas beaucoup d'intérêt de la part des scientifiques. Des simulations de supercalcul ont ensuite permis aux chercheurs de développer des films dynamiques qui ont révélé des portes glycanes s'activant d'une position à une autre, offrant un morceau sans précédent de l'histoire de l'infection.
"Nous avons en fait pu regarder l'ouverture et la fermeture", a déclaré Amaro. « C'est l'une des choses vraiment intéressantes que ces simulations vous offrent : la possibilité de voir des films vraiment détaillés. Lorsque vous les regardez, vous réalisez que vous voyez quelque chose que nous aurions autrement ignoré. Vous regardez juste la structure fermée, puis vous regardez la structure ouverte, et ça ne ressemble à rien de spécial. C'est seulement parce que nous avons capturé le film de l'ensemble du processus que vous le voyez réellement faire son travail.
"Les techniques standard auraient nécessité des années pour simuler ce processus d'ouverture, mais avec les outils de simulation avancés" d'ensemble pondéré "de mon laboratoire, nous avons pu capturer le processus en seulement 45 jours", a déclaré Chong.
Les simulations à forte intensité de calcul ont d'abord été exécutées sur Comet au San Diego Supercomputer Center de l'UC San Diego, puis sur Longhorn au Texas Advanced Computing Center de l'UT Austin. Une telle puissance de calcul a fourni aux chercheurs des vues au niveau atomique du domaine de liaison du récepteur de protéine de pointe, ou RBD, à partir de plus de 300 perspectives. Les enquêtes ont révélé que le glycane "N343" était la cheville ouvrière qui fait passer le RBD de la position "bas" à "haut" pour permettre l'accès au récepteur ACE2 de la cellule hôte. Les chercheurs décrivent l'activation du glycane N343 comme similaire à un mécanisme de « pied de biche moléculaire ».
Jason McLellan, professeur agrégé de biosciences moléculaires à UT Austin et son équipe ont créé des variantes de la protéine de pointe et testé pour voir comment un manque de porte glycane affectait la capacité du RBD à s'ouvrir.
"Nous avons montré que sans cette porte, le RBD de la protéine de pointe ne peut pas prendre la conformation dont il a besoin pour infecter les cellules", a déclaré McLellan.
Référence : "Une porte glycane contrôle l'ouverture de la protéine de pointe du SRAS-CoV-2" par Terra Sztain, Surl-Hee Ahn, Anthony T. Bogetti, Lorenzo Casalino, Jory A. Goldsmith, Evan Seitz, Ryan S. McCool, Fiona L Kearns, Francisco Acosta-Reyes, Suvrajit Maji, Ghoncheh Mashayekhi, J. Andrew McCammon, Abbas Ourmazd, Joachim Frank, Jason S. McLellan, Lillian T. Chong et Rommie E. Amaro, 19 août 2021, Nature Chemistry.
DOI: 10.1038/s41557-021-00758-3
La liste complète des auteurs comprend : Terra Sztain, Surl-Hee Ahn, Anthony Bogetti, Lorenzo Casalino, Jory Goldsmith, Evan Seitz, Ryan McCool, Fiona Kearns, Francisco Acosta-Reyes, Suvrajit Maji, Ghoncheh Mashayekhi, J. Andrew McCammon, Abbas Ourmazd , Joachim Frank, Jason McLellan, Lillian Chong et Rommie Amaro.









