Die meisten Säugetiere, einschließlich Menschen, haben zwei Geschlechtschromosomen, X und Y. Ein Geschlechtschromosom wird normalerweise von jedem Elternteil geerbt, und sie paaren sich in jeder Körperzelle entweder als XX oder XY. Menschen mit XX-Chromosomen identifizieren sich typischerweise als weiblich, und Menschen mit XY-Chromosomen identifizieren sich typischerweise als männlich. Die Gene auf diesen Chromosomen spielen eine Schlüsselrolle bei der Entwicklung und Funktion – einschließlich wie Herzkrankheiten entstehen.
Bevor ich ein wurde Biomedizintechniker Als ich untersuchte, wie Geschlechtschromosomen das Herz beeinflussen, lernte ich in meinem Naturwissenschaftsunterricht an der High School etwas über eine merkwürdige Funktion von X-Chromosomen Kaliko katze Beispiel.
Weibliche Calico-Katzen haben fast immer orange und schwarze Fellflecken, weil das Gen, das die Fellfarbe definiert, auf dem X-Chromosom gefunden wird. Wenn sich eine orangefarbene Katze mit einer schwarzen Katze paart, haben weibliche Nachkommen, die typischerweise ein X-Chromosom von jedem Elternteil erben, eine Mischung aus orangefarbenem und schwarzem Fell – ein X-Chromosom kodiert für orangefarbenes Fell, während das andere für schwarzes Fell kodiert. Aus diesem Grund haben männliche Katzen, die typischerweise ein X- und ein Y-Chromosom haben, ein einfarbiges orangefarbenes oder schwarzes Fell.
Kaliko- und Schildpattkatzen haben mehrfarbige Fellflecken, weil nur eines ihrer beiden X-Chromosomen in jeder Zelle aktiviert ist.
Wie kommt dieser Geschlechtsunterschied in der Fellfarbe biologisch zustande? Wie sich herausstellt, erleben Zellen mit XX-Chromosomen X-Inaktivierung: Das X-Chromosom eines Elternteils ist in einigen Zellen ausgeschaltet, während das vom anderen Elternteil geerbte X-Chromosom in anderen ausgeschaltet ist. In den Zellen weiblicher Calico-Katzen kann die X-Inaktivierung zu orangefarbenen und schwarzen Fellflecken führen, wenn ein X-Chromosom von einem Elternteil mit orangefarbenem Fell und das andere X-Chromosom von einem Elternteil mit schwarzem Fell stammt.
X-Inaktivierung tritt auf, weil Organismen wie Katzen und Menschen nur ein X-Chromosom benötigen, um richtig zu funktionieren. Um die richtige „Dosierung“, ist in jeder Zelle eines der X-Chromosomen ausgeschaltet. Aber einige der Gene auf dem inaktivierten X-Chromosom Inaktivierung entgehen und eingeschaltet bleiben. In der Tat, bis zu einem Drittel der Gene auf dem X-Chromosom beim Menschen können der Inaktivierung entgehen, und man nimmt an, dass sie dabei eine Rolle spielen Gesundheit und Krankheit regulieren.
Da die X-Inaktivierung nur bei Menschen mit mehr als einem X-Chromosom auftritt, haben Forscher wie ich untersucht, wie sich die Gene, die der Inaktivierung auf dem zweiten X entkommen, auf die Gesundheit von Menschen mit XX-Chromosomen auswirken. Wir haben festgestellt, dass für bestimmte Bedingungen Zellsex mag der Kern der Sache sein.
Eine Veränderung des Herzens
Eine Krankheit, die X-Chromosom-Escape-Gene teilweise regulieren, ist Aortenklappenstenose, ein Zustand, bei dem sich der Teil des Herzens, der den Blutfluss zum Rest des Körpers steuert, versteift und verengt. Dadurch muss das Herz schwerer arbeiten, um Blut zu pumpen, und kann letztendlich zu Herzversagen führen. Ähnlich wie bei einer Person, die versucht, eine Tür mit rostigen Scharnieren aufzustoßen, wird das Herz müde. Derzeit sind keine wirksamen Medikamente verfügbar, um die Symptome der AVS-Krankheit zu verlangsamen oder zu stoppen.
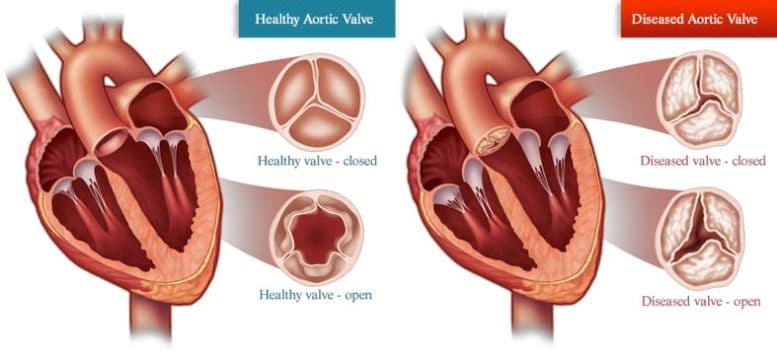
Herzen mit Aortenklappenstenose müssen stärker pumpen, um Blut durch eine verengte Aortenklappe in den Rest des Körpers zu drücken. Bildnachweis: SuneErichsen/Wikimedia Commons, CC BY-SA
Im Großen und Ganzen, denken Forscher Sexualhormone fahren Geschlechtsunterschiede in Klappengewebe Versteifung. In der Tat, abnehmender Östrogenspiegel in den Wechseljahren kann Herzfibrose verschlimmern. Studien zu Herz-Kreislauf-Erkrankungen bei XX- und XY-Mäusen haben jedoch ergeben, dass die Geschlechtsunterschiede auch danach bestehen bleiben chirurgisch ausschneiden die Fortpflanzungsorgane, die Sexualhormone produzieren.
Mein Team und ich hypothetisch angenommenen dass die Gene, die der X-Inaktivierung entkommen, die nur bei Menschen mit XX-Chromosomen vorkommen, diese Unterschiede bei der Klappenversteifung antreiben könnten. Um diese Idee zu testen, haben wir biotechnologisch hergestellte Modelle von Klappengewebe entwickelt Hydrogele. Hydrogele ahmen die Steifheit von Klappengewebe nach besser als das herkömmliche Petrischalenmedium, wodurch wir Herzzellen in einer Umgebung untersuchen können, die dem Körper ähnlicher ist.
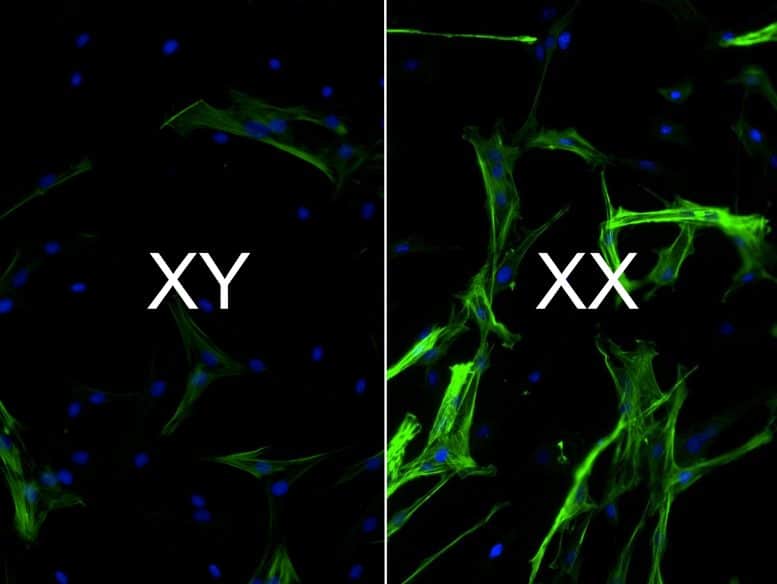
Herzgewebe mit XX-Chromosomen hat eine höhere Konzentration an Zellen (grün gefärbt, mit blauen Kernen), die die Narbenbildung fördern, als Zellen mit XY-Chromosomen. Bildnachweis: Brian Aguado, CC BY-NC-ND
Wir fanden heraus, dass die Zellen, die wir auf unseren Hydrogelmodellen gezüchtet haben, in der Lage waren, die im Klappengewebe beobachteten Geschlechtsunterschiede zu replizieren – nämlich Klappenzellen mit XX-Chromosomen wiesen mehr Narben auf als Zellen mit XY-Chromosomen. Darüber hinaus konnten wir, als wir die Aktivität von Genen verringerten, die der X-Inaktivierung entgingen, die Narbenbildung in XX-Chromosomzellen verringern.
Unser nächster Schritt war die Verwendung unserer Modelle, um basierend auf dem Zellgeschlecht zu bestimmen, welche Behandlungen für AVS am besten funktionieren. Wir fanden heraus, dass XX-Klappenzellen weniger empfindlich auf diese Medikamente reagierten als XY-Zellen, die auf Gene abzielten, die die Narbenbildung fördern. Medikamente, die speziell auf Gene abzielen, die der X-Inaktivierung entkommen, haben jedoch eine stärkere Wirkung auf XX-Zellen.
Gleichberechtigte Pflege für alle
Geschlecht und geschlechtsspezifische Unterschiede bei Herz-Kreislauf-Erkrankungen sind weit verbreitet. Zum Beispiel, Frauen sind weniger wahrscheinlich als Männer, denen trotz Leitlinienempfehlungen kardiovaskuläre Medikamente verschrieben werden, und Transgender-Personen haben höhere Raten von Herzinfarkten als Cisgender-Leute.
Unsere Arbeit macht einen weiteren Schritt in Richtung Gerechtigkeit bei der Entwicklung medizinischer Therapeutika für Herz-Kreislauf-Erkrankungen. Durch die Berücksichtigung von Geschlechtschromosomen glauben mein Team und ich, dass Behandlungsstrategien für alle optimiert werden können, unabhängig von der Zelle „seXX“.
Geschrieben von Brian Aguado, Assistenzprofessor, University of California San Diego.
Dieser Artikel wurde zuerst in veröffentlicht Das Gespräch.









